Водородный показатель, $pH$ — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
$$ pH = -\mathrm{lg}[H^+].$$В чистой воде при 25 °C концентрации ионов водорода $[H^+]$ и гидроксид-ионов $[OH^−]$ одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно $[H^+]·[OH^−]$ и составляет 10−14 моль2/л2.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда $[H^+] > [OH^−]$ говорят, что раствор является кислотным, а при $[OH^−] > [H^+]$ — основным.
При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается $pH < 7$ (что соответствует одновременно возросшим концентрациям как $H^+$, так и $OH^−$); при понижении температуры, напротив, нейтральная $pH$ возрастает.
Для определения значения $pH$ растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от $pH$ среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1–2 единицы.
Для расширения рабочего интервала измерения $pH$ используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в основную. Определения $pH$ индикаторным методом затруднено для мутных или окрашенных растворов.
Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
Использование специального прибора — pH-метра — позволяет измерять $pH$ в более широком диапазоне и более точно (до 0.01 единицы $pH$), чем с помощью индикаторов. Ионометрический метод определения $pH$ основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов $H^+$ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне $pH$, позволяет измерять $pH$ непрозрачных и цветных растворов и потому широко используется.
pH-метр — прибор для измерения водородного показателя (показателя $pH$), характеризующего активность ионов водорода в растворах, воде, пищевой продукции и сырьё, объектах окружающей среды и производственных системах непрерывного контроля технологических процессов, в том числе в агрессивных средах. В частности, pH-метр применяется для аппаратного мониторинга $pH$ растворов разделения урана и плутония, где требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.

Действие pH-метра основано на измерении величины ЭДС электродной системы, которая пропорциональна активности ионов водорода в растворе — $pH$ (водородному показателю). Измерительная схема по сути представляет собой вольтметр, проградуированный непосредственно в единицах $pH$ для конкретной электродной системы (обычно измерительный электрод — стеклянный, вспомогательный — хлорсеребряный).
Входное сопротивление прибора должно быть очень высоким — входной ток не более 10−10 А (у хороших приборов менее 10−12 А), сопротивление изоляции между входами не менее 1011 Ом, что обусловлено высоким внутренним сопротивлением зонда — стеклянного электрода. Это основное требование к входной схеме прибора.
Исторически, сначала ЭДС измерялась компенсационным методом с помощью потенциометра и чувствительного гальванометра. Когда схема в равновесии, ток через гальванометр не течет, и нагрузка на электроды не действует — по шкале потенциометра корректно отсчитывается ЭДС. Так же применялся метод с баллистическим гальванометром. Сначала от электродов заряжался конденсатор, затем он разряжался на рамку гальванометра, максимальное отклонение которой пропорционально заряду конденсатора, а следовательно — напряжению.
Далее появились приборы с входным усилителем на электронных лампах. Специальные («электрометрические») лампы имеют ток утечки сетки порядка пикоампер, что позволяет получать большие входные сопротивление. Недостатком таких схем является большой дрейф и уход калибровки из-за неизбежного старения и изменения характеристик лампы.
Решить проблему дрейфа и одновременно высокого входного сопротивления позволили компенсационные схемы с усилителем, построенным по принципу модулятор — демодулятор. Механический ключ (вибропреобразователь) поочередно соединяет небольшой конденсатор с входом и цепью обратной связи. Если постоянные напряжения на них отличаются, то через конденсатор протекает небольшой переменный ток, который создаст переменное напряжение на сеточном резисторе входной лампы. Далее пульсации усиливаются несколькими каскадами, и поступают на фазочувствительный демодулятор (в простейшем случае — такой же вибропреобразователь, электромагнит которого включен параллельно электромагниту первого). На выходе получается напряжение, пропорциональное разности напряжений на входе. Цепь обратной связи (резистивный делитель) задает общий коэффициент усиления, стремясь поддерживать на входе усилителя нулевую разность напряжений. Эта схема практически лишена дрейфа, усиление мало зависит от степени износа ламп. Снижается требования к самим лампам — вместо дорогих электрометрических можно применять массовые приёмно-усилительные лампы.
В более поздних моделях вместо контактного преобразователя применялся динамический конденсатор, позднее ключ на фотосопротивлении, освещаемом импульсами света, а лампы на входе сменились полевыми транзисторами.
В настоящее время большинство прецизионных операционных усилителей с входом на полевых МОП-транзисторах, и даже простейшие АЦП удовлетворяют требованиям по входному сопротивлению.
Так как ЭДС электродной системы сильно зависит от температуры, то важной является схема термокомпенсации. Изначально применялись медные термометры сопротивления, включенные в сложные мостовые схемы обратной связи, или потенциометр со шкалой в градусах, ручкой которого устанавливали значение температуры, измеренное ртутным термометром. Такие схемы имеют большое число подстроечных резисторов и крайне сложны в настройке и калибровке. Сейчас датчик температуры работает на отдельный АЦП, все необходимые корректировки вносит микроконтроллер.
Примерная зависимость напряжения от pH (для системы со стеклянным и хлорсеребряным электродами) следующая.
Большинство современных стеклянных электродов делают так, чтобы в паре с хлорсеребряным ЭДС была примерна равна нулю при $pH = 7$, то есть в нейтральной среде.
При основном (щелочном) $pH$, (но, обычно, не более 14 — предел для стеклянных электродов) напряжение на выходе датчика варьируется от 0 до −0.41 В. При кислотном $pH$, напряжение на выходе датчика колеблется от 0 до +0.41 В.
Две главные настройки выполняются при калибровке по буферным растворам с точно известным значением $pH$ — устанавливается крутизна усиления и смещение нуля. Так же настраивается так называемая изопотенциальная точка (pHи, Eи) — значение $pH$ и соответствующая ему ЭДС, при которых ЭДС системы не зависит от температуры. Современные электродные системы (за исключением специальных электродов для сильных кислот и щелочей) делают с изопотенциальной точкой около $pH = 7$ и ЭДС в пределах +/- 50мВ. Эти характеристики указываются для каждого типа стеклянного электрода.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных сред.
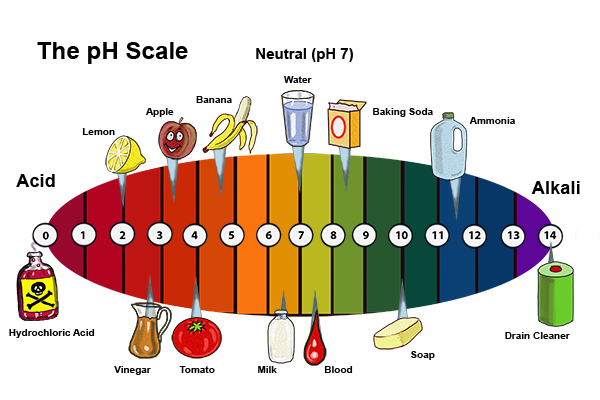
Кислотность среды имеет важное значение для множества химических процессов.