Газы, как и жидкости, реагируют на изменения температуры. Это свойство газов можно контролировать и применить в газовых манометрических системах для измерения температуры.
Для того, чтобы понять как газы реагируют на изменения температуры, давайте сначала обратимся к одному из основных законов физики - Закону Бойля. В целом, Закон Бойля относится к идеальным газам (газам, содержащимся в закрытых емкостям) и гласит, что при постоянной температуре удельный объем данного идеального газа обратно пропорционален давлению. Например, если давление на газ увеличивается вдвое, то удельный объем газа уменьшиться вдвое, если температура будет оставаться неизменной.
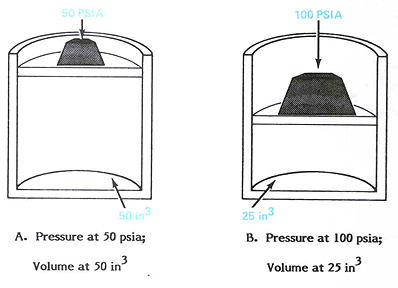
Закон Бойля также применим и в случае падения давления. Например, когда давление на идеальный газ уменьшается наполовину, то удельный объем увеличивается вдвое, при условии, что температура остается неизменной. Математически Закон Бойля можно выразить следующим образом:
$$p_1·v_1 = p_2·v_2,$$где $p_1 - $ - начальное давление; $v_1$ - начальный объем; $p_2$ – увеличенное или уменьшенное давление; $v_2$ - уменьшенный или увеличенный объем.
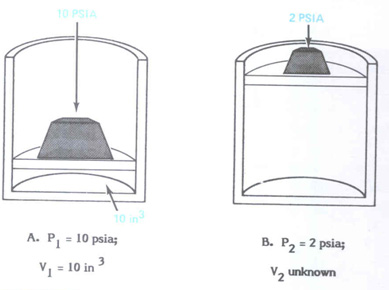
Используя эти значения и формулу Закона Бойля можно определить объем цилиндра после того, как давление уменьшилось по формуле:
$$v_2 = \frac{p_1·v_1}{p_2}.$$Если температура газа повышается, то его давление или объем изменятся прямо пропорционально увеличению температуры. Аналогично, если температура газа уменьшится, то его давление или объем уменьшаться прямо пропорционально изменению температуры. Уравнение, которое объясняет взаимосвязь температуры, давления и удельного объема будет иметь следующий вид:
$$\frac{p_1·v_1}{T_1} = \frac{p_2·v_2}{T_2}.$$где $p_1 - $ - начальное давление; $v_1$ - начальный объем; $T_1$ - начальная температура; $p_2$ – увеличенное или уменьшенное давление; $v_2$ - увеличенный или уменьшенный объем; $T_2$ - увеличенная или уменьшенная температура.
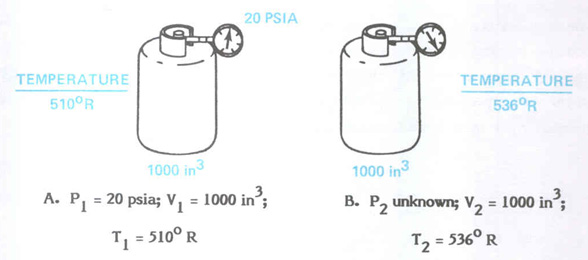
Если объем неизменен, тогда температуру можно рассчитать из условия:
$$T_2 = \frac{p_2}{p_1}·T_1.$$Этот пример объясняет принцип работы газовых манометрических систем, так как газ в манометрической системе имеет постоянный объем внутри шарика термометра, капиллярной трубки и трубки Бурдона.
Газовая система по конструкции напоминает жидкостную манометрическую систему.
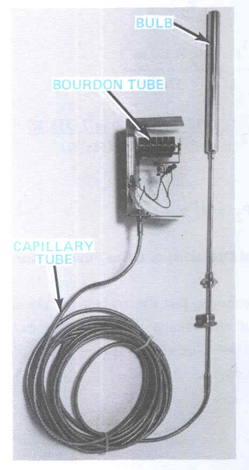
Газ в газовой системе ведет себя подобно жидкости в жидкостной манометрической системе. Когда шарик нагревается, то температура газа, находящегося внутри повышается, поэтому и давление, оказываемое газом на трубку Бурдона, также повышается. Это повышение давления заставляет трубку Бурдона пытаться распрямиться. Перемещение трубки Бурдона передвигает стрелку на деления, соотетствующие более высокому значению на шкале. Когда температура газа уменьшается, то и давление на трубку Бурдона уменьшается. Трубка Бурдона опять скручивается, двигая стрелку на более низкие значения шкалы.
Манометрический термометр — прибор для измерения температуры, действие которого основано на изменении давления какого-либо вещества (жидкости или газа) при изменении температуры, основанный на законе Шарля.